Es bien sabido que en el dogma central, el ARN es el mediador transcripcional entre el ADN y la expresión de proteínas.En comparación con la detección de ADN, la detección de ARN puede reflejar de forma más objetiva la expresión génica en los organismos.Los experimentos que involucran ARN incluyen: qRT-PCR, RNA-Seq y detección de genes de fusión, etc. Según las características del propio ARN (el anillo de azúcar del ARN tiene un grupo hidroxilo libre más que el anillo de azúcar del ADN), junto con una gran cantidad de RNasas en el medio ambiente, el ARN es más inestable y más fácil de degradar que el ADN.Basura entra, basura sale, si la calidad del ARN no es buena, entonces los resultados experimentales deben ser insatisfactorios, manifestándose específicamente como datos inexactos o mala repetibilidad.Por lo tanto, se debe prestar más atención al procesamiento del ARN, y el vínculo del control de calidad también es más importante para garantizar la precisión y exactitud de los datos experimentales posteriores.
Para el control de calidad del ARN, generalmente existen los siguientes métodos comúnmente utilizados:
- Espectrofotometría
- electroforesis en gel de agarosa
- Bioanalizador Agilent
- PCR cuantitativa fluorescente en tiempo real
- Método de colorante fluorescente Qubit
01 Espectrofotometría
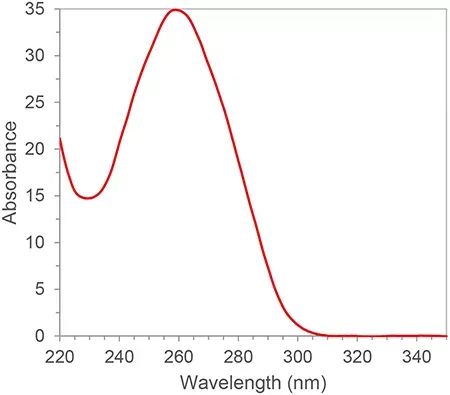
El ARN tiene enlaces dobles conjugados y tiene un pico de absorción a una longitud de onda de 260 nm.De acuerdo con la ley de Lambert-Beer, podemos calcular la concentración de ARN a partir del pico de absorción a 260 nm.Además, también podemos calcular la pureza del ARN según la proporción de picos de absorción de 260 nm, 280 nm y 230 nm.280nm y 230nm son los picos de absorción de proteínas y moléculas pequeñas, respectivamente.La proporción de A260/A280 y A260/A230 de pureza calificada de ARN debe ser superior a 2. Si es inferior a 2, significa que hay contaminación de proteína o molécula pequeña en la muestra de ARN y debe purificarse nuevamente.Las fuentes de contaminación afectarán los experimentos posteriores, como la inhibición de la eficiencia de amplificación de las reacciones de PCR, lo que dará como resultado resultados cuantitativos inexactos.La pureza del ARN tiene una gran influencia en los resultados posteriores, por lo que la espectrofotometría suele ser un eslabón de control de calidad indispensable en el primer paso de los experimentos con ácidos nucleicos.
Figura 1. Espectro típico de absorción de ARN/ADN
02 Electroforesis en gel de agarosa
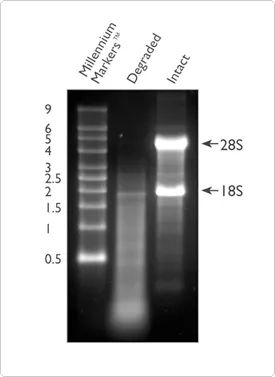
Además de la pureza, la integridad del ARN también es uno de los indicadores importantes para juzgar la calidad del ARN.La degradación del ARN dará lugar a una gran cantidad de fragmentos cortos en la muestra, por lo que se reducirá la cantidad de fragmentos de ARN que se pueden detectar y cubrir de manera efectiva con la secuencia de referencia.La integridad del ARN se puede comprobar mediante electroforesis del ARN total en un gel de agarosa al 1%.Este método puede configurar el gel usted mismo o usar el sistema E-Gel™ prefabricado para la prueba de integridad.Más del 80 % del ARN total es ARN ribosómico, la mayoría del cual está compuesto por ARNr 28S y 18S (en sistemas de mamíferos).El ARN de buena calidad mostrará dos barras brillantes obvias, que son barras brillantes 28S y 18S, respectivamente, a 5 Kb y 2 Kb, y la relación tenderá a ser cercana a 2:1.Si está en un estado difuso, significa que la muestra de ARN puede haberse degradado y se recomienda utilizar el método que se describe más adelante para probar más la calidad del ARN.
Figura 2. Comparación de ARN degradado (carril 2) e intacto (carril 3) en electroforesis en gel de agarosa
03 Bioanalizador Agilent
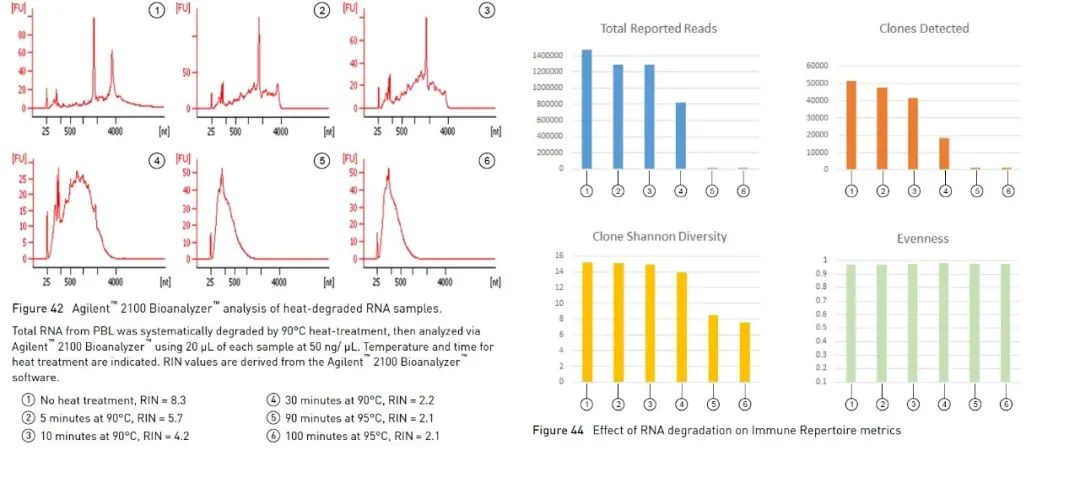
Además del método de electroforesis en gel de agarosa descrito anteriormente, que puede ayudarnos a identificar la integridad del ARN de forma sencilla y rápida, también podemos utilizar el bioanalizador de Agilent para determinar la integridad del ARN.Utiliza una combinación de microfluidos, electroforesis capilar y fluorescencia para evaluar la concentración e integridad del ARN.Mediante el uso del algoritmo integrado para analizar el perfil de la muestra de ARN, el bioanalizador de Agilent puede calcular un valor de integridad de ARN de referencia, el número de integridad de ARN (en lo sucesivo, RIN) [1].Cuanto mayor sea el valor de RIN, mayor será la integridad del ARN (1 es extremadamente degradado, 10 es el más completo).Algunos experimentos que involucran ARN sugieren usar RIN como parámetro para la evaluación de la calidad.Tomando como ejemplo los experimentos de secuenciación de alto rendimiento (en lo sucesivo, NGS), las directrices del repertorio inmunológico humano Oncomine™, que se utiliza para detectar receptores de antígenos de células B y células T en la serie de paneles Oncomine de Thermo Fisher, sugieren que las muestras con valores RIN superiores a 4 pueden medir lecturas y clones más efectivos (Figura 3).Hay diferentes rangos recomendados para diferentes paneles y, a menudo, un RIN más alto puede brindar datos más efectivos.
Figura 3, en los experimentos de Oncomine™ Human Immune Repertoire, las muestras con RIN superior a 4 pueden detectar lecturas y clones de células T más efectivos.【2】
Sin embargo, el valor de RIN también tiene algunas limitaciones.Aunque RIN tiene una alta correlación con la calidad de los datos experimentales de NGS, no es adecuado para muestras FFPE.Las muestras de FFPE se han tratado químicamente durante mucho tiempo y el ARN extraído generalmente tiene un valor RIN relativamente bajo.Sin embargo, esto no significa que los datos efectivos del experimento deban ser insatisfactorios.Para evaluar con precisión la calidad de las muestras FFPE, necesitamos utilizar medidas distintas de RIN.Además de RIN, el bioanalizador Agilent también puede calcular el valor DV200 como parámetro de evaluación de la calidad del ARN.DV200 es un parámetro que calcula la proporción de fragmentos de más de 200 pb en una muestra de ARN.DV200 es un mejor indicador de la calidad de la muestra FFPE que RIN.Para el ARN extraído por FFPE, tiene una correlación muy alta con la cantidad de genes que se pueden detectar de manera efectiva y la diversidad de genes [3].Aunque DV200 puede compensar las deficiencias en la detección de calidad de FFPE, el bioanalizador de Agilent todavía no puede analizar de forma exhaustiva los problemas de calidad en las muestras de ARN, incluido si hay inhibidores en las muestras.Los propios inhibidores pueden afectar la eficiencia de amplificación de los experimentos posteriores y reducir la cantidad de datos útiles.Para saber si hay un inhibidor en la muestra, podemos adoptar el método de PCR cuantitativa fluorescente en tiempo real que se describe a continuación.
04 PCR cuantitativa fluorescente en tiempo real
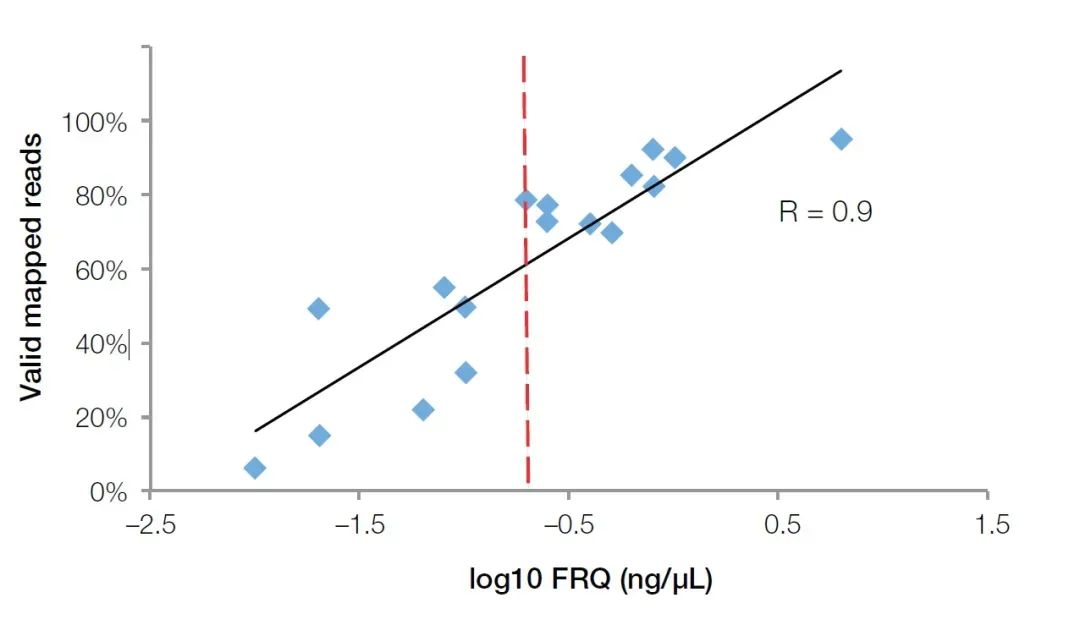
El método de PCR cuantitativa fluorescente en tiempo real no solo puede detectar los inhibidores en la muestra, sino que también refleja con precisión la calidad del ARN en la muestra FFPE.En comparación con los analizadores biológicos de Agilent, los instrumentos cuantitativos de fluorescencia en tiempo real son más populares en los principales laboratorios biológicos debido a su aplicación más amplia.Para probar la calidad de las muestras de ARN, solo necesitamos comprar o preparar sondas de cebador para genes de referencia interna, como GUSB (n.º de cat. Hs00939627).Mediante el uso de este conjunto de cebadores, sondas y estándares (ARN total de concentración conocida) para realizar experimentos cuantitativos absolutos, la concentración efectiva de fragmentos de ARN se puede calcular como el estándar de evaluación de la calidad del ARN (Cuantificación de ARN funcional (FRQ) para abreviar).En una prueba de NGS, encontramos que la FRQ de las muestras de ARN tiene una correlación muy alta con el volumen de datos efectivo.Para todas las muestras superiores a 0,2 ng/uL FRQ, al menos el 70 % de las lecturas pueden cubrir efectivamente la secuencia de referencia (Figura 4).
Figura 4, el valor de FRQ detectado por el método cuantitativo de fluorescencia tiene una correlación muy alta (R2>0.9) con los datos efectivos obtenidos en el experimento NGS.La línea roja es el valor FRQ igual a 0,2 ng/uL (log10 = -0,7).【4】
Además de ser aplicable a las muestras FFPE, el método de PCR cuantitativa en tiempo real también puede monitorear de manera efectiva los inhibidores en las muestras.Podemos agregar la muestra a detectar en el sistema de reacción con el control positivo interno (IPC) y su ensayo, y luego realizar la cuantificación de fluorescencia para obtener el valor de Ct.Si el valor de Ct va a la zaga del valor de Ct en la reacción sin muestra, indica que el inhibidor está presente en la muestra e inhibe la eficiencia de amplificación en la reacción.
05 Método de colorante fluorescente Qubit
El fluorómetro Qubit es el dispositivo pequeño más utilizado para la detección de pureza y concentración de ácidos nucleicos, que es fácil de operar y existe en casi todos los laboratorios de biología molecular.Calcula con precisión la concentración de ácido nucleico mediante la detección de un colorante fluorescente que se une al ácido nucleico (reactivo de detección Qubit).Qubit tiene una alta sensibilidad y especificidad, y puede cuantificar con precisión el ARN hasta una concentración de pg/µL.Además de la conocida capacidad de cuantificar con precisión la concentración de ácido nucleico, el último modelo nuevo de Thermo Fisher, Qubit 4.0, también puede detectar la integridad del ARN.El sistema de detección de ARN de Qubit 4.0 (ensayo RNA IQ) detecta la integridad del ARN mediante la detección simultánea de dos colorantes fluorescentes específicos.Estos dos colorantes fluorescentes pueden unirse a fragmentos grandes y pequeños de ARN, respectivamente.Estos dos tintes fluorescentes indican la proporción de fragmentos grandes de ARN en la muestra y, a partir de esto, se puede calcular el valor de IQ (Integridad y calidad) que representa la calidad del ARN.El valor de IQ es aplicable a muestras FFPE y no FFPE y tiene una gran influencia en la calidad de la secuenciación posterior.Tomando los experimentos de NGS como ejemplo, en los experimentos de prueba de RNA-Seq realizados en la plataforma Ion torrent™, la mayoría de las muestras con valores de CI superiores a 4 tuvieron al menos un 50 % de lecturas efectivas (Figura 5).En comparación con los métodos de detección mencionados anteriormente, el ensayo Qubit IQ no solo es más conveniente de operar y toma menos tiempo (en cinco minutos), sino que también tiene una gran correlación entre el valor de IQ del parámetro medido y la calidad de los datos de los experimentos posteriores.
Figura 5, existe una gran correlación entre el valor de Qubit RNA IQ y las lecturas asignadas de RNA-Seq.【5】
A través de la introducción anterior, creo que todos tienen una comprensión suficiente de los diferentes métodos de control de calidad del ARN.En la práctica, puede elegir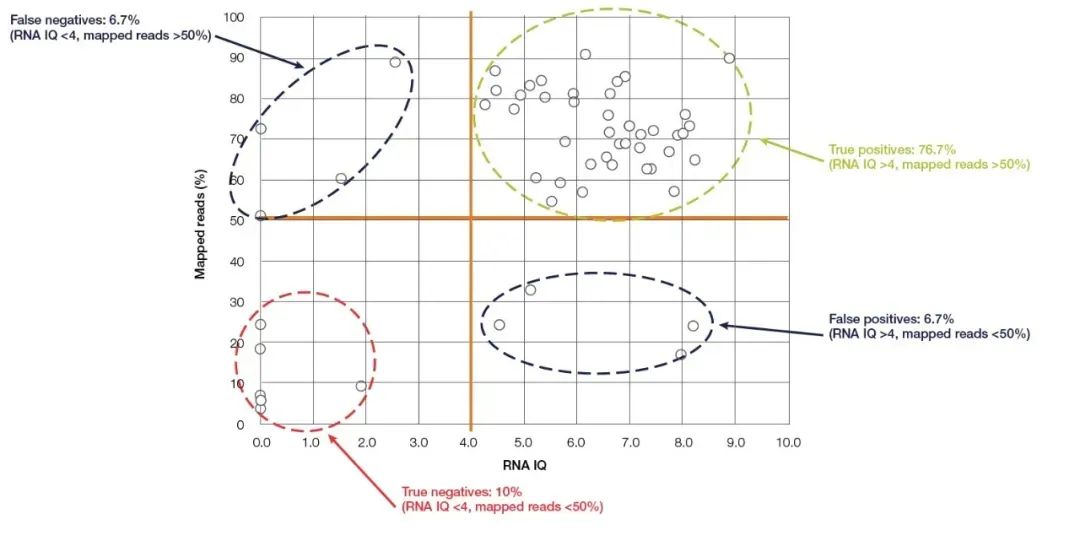 el método correspondiente según el tipo de muestra e instrumentos existentes.Solo controlando bien la calidad del ARN podemos evitar el fracaso de los experimentos posteriores causados por la mala calidad de la muestra, ahorrando así un tiempo, una energía y un coste preciosos.
el método correspondiente según el tipo de muestra e instrumentos existentes.Solo controlando bien la calidad del ARN podemos evitar el fracaso de los experimentos posteriores causados por la mala calidad de la muestra, ahorrando así un tiempo, una energía y un coste preciosos.
Productos de referencia:
Kit de aislamiento de ARN total animal
Kit de aislamiento de ARN total de células
referencias
【1】Schroeder, A., Mueller, O., Stocker, S. et al.El RIN: un número de integridad de ARN para asignar valores de integridad a las mediciones de ARN.BMC Molecular Biol 7, 3 (2006).https:// doi.org/10.1186/1471-21 99-7-3
【2】Guía del usuario del repertorio inmunitario humano de Oncomine (n.º de publicación MAN0017438 Rev. C.0).
【3】Leah C Wehmas, Charles E Wood, Brian N Chorley, Carole L Yauk, Gail M Nelson, Susan D Hester, Métricas de calidad mejoradas para evaluar el ARN derivado de muestras de tejido embebidas en parafina fijadas con formalina de archivo, Ciencias toxicológicas, volumen 170, número 2, agosto de 2019, páginas 357–373,https://doi.org/10.1093/toxsci/
Hora de publicación: 12-jun-2023