En los experimentos de qPCR, el diseño de cebadores también es un vínculo muy importante.El hecho de que los cebadores sean adecuados o no está estrechamente relacionado con si la eficiencia de la amplificación alcanza el estándar, si los productos amplificados son específicos y si los resultados experimentales están disponibles.
Entonces, ¿cómo mejorar la especificidad del cebador qPCR?¿Alta eficiencia de amplificación?
Hoy, lo llevaremos a diseñar cebadores de qPCR juntos y dejaremos que el diseño de cebadores de qPCR se convierta en una habilidad de conocimientos eficiente en los experimentos.
Cuando diseñe cebadores de qPCR, por lo general, preste atención a los siguientes puntos: los cebadores deben diseñarse a través de intrones tanto como sea posible, la longitud del producto debe ser de 100-300 pb, el valor de Tm debe estar lo más cerca posible de 60 ° C, y los cebadores aguas arriba y aguas abajo deben estar lo más cerca posible, y el final del cebador debe ser G o C, etc. espere.
1. Diseño de cebadores que abarcan intrones
Al diseñar cebadores de qPCR, elegir cebadores diseñados a través de intrones puede evitar que se amplifique la plantilla de gDNA, y todos los productos se derivan de la amplificación de cDNA, eliminando así la influencia de la contaminación de gDNA.
2. Longitud de la imprimación
La longitud del cebador es generalmente entre 18 y 30 nt, y la longitud del producto de amplificación debe controlarse entre 100 y 300 pb tanto como sea posible.
Si el cebador es demasiado corto, dará lugar a una amplificación no específica, y si es demasiado largo, formará fácilmente una estructura secundaria (como una estructura de horquilla).Si el producto de amplificación es demasiado largo, no es adecuado para la reacción de la polimerasa, lo que afectará la eficiencia de la amplificación por PCR.
3. Contenido GC y valor Tm
El contenido de GC de los cebadores debe controlarse entre el 40 % y el 60 %.Si es demasiado alto o demasiado bajo, no es propicio para iniciar la reacción.El contenido de GC de los cebadores directo e inverso debe ser similar para obtener el mismo valor de Tm y la misma temperatura de recocido.
El valor de Tm debe estar entre 55-65°C en la medida de lo posible, generalmente alrededor de 60°C, y el valor de Tm de aguas arriba y aguas abajo debe ser lo más cercano posible, preferiblemente no más de 4°C.
4. Evite seleccionar A en el extremo 3′ del cebador
Cuando el extremo 3 'del cebador no coincide, existen grandes diferencias en la eficiencia de síntesis de diferentes bases.Cuando la última base es A, también puede iniciar la síntesis de la cadena incluso en el caso de un desajuste, y cuando la última base es T, la eficacia de la inducción del desajuste se reduce considerablemente.Por lo tanto, trate de evitar elegir A en el extremo 3 'del cebador, y es mejor elegir T.
Si se trata de un cebador de sonda, el extremo 5 'de la sonda no puede ser G, porque incluso cuando una sola base G está conectada al grupo informador fluorescente FAM, G también puede apagar la señal fluorescente emitida por el grupo FAM, lo que da como resultado resultados falsos negativos.Aparecer.
5. Distribución básica
La distribución de las cuatro bases en el cebador es preferentemente aleatoria, evitando más de 3 G o C consecutivas en el extremo 3′, y más de 3 consecutivasG o C son fáciles de generar emparejamiento en la región de secuencia rica en GC.
6. La región de diseño del cebador debe evitar estructuras secundarias complejas.
La estructura secundaria formada por la hebra simple del producto de amplificación afectará el buen progreso de la PCR.Al predecir de antemano si hay una estructura secundaria en la secuencia objetivo, intente evitar esta región en el diseño de los cebadores.
7. Los cebadores en sí mismos y entre los cebadores deben tratar de evitar bases complementarias consecutivas.
No puede haber complementariedad de 4 bases consecutivas entre el propio cebador y el cebador.El cebador en sí no debe tener una secuencia complementaria, de lo contrario se plegará para formar una estructura de horquilla, lo que afectará la combinación de hibridación del cebador y la plantilla.
No pueden existir secuencias complementarias entre los cebadores aguas arriba y aguas abajo.La complementariedad entre los cebadores producirá dímeros de cebadores, lo que reducirá la eficacia de la PCR e incluso afectará a la precisión cuantitativa.Si las estructuras de dímero de cebador y horquilla son inevitables, el valor de △G no debe ser demasiado alto (debe ser inferior a 4,5 kcal/mol).
8. Los cebadores amplifican el producto específico objetivo.
El objetivo final de la detección de qPCR es comprender la abundancia del gen objetivo.Si se produce una amplificación no específica, la cuantificación será inexacta.Por lo tanto, después de diseñar los cebadores, deben probarse con BLAST y la especificidad de los productos se compara en la base de datos de secuencias.
A continuación, tomamos el gen humano GAS6 (específico de detención del crecimiento 6) como ejemplo para diseñar cebadores de qPCR.
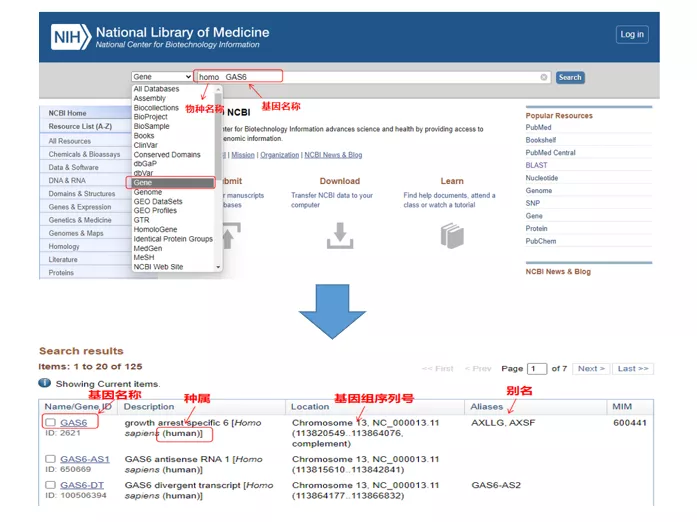
01 gen de consulta
Homosexual GAS6a través del NCBI.Aquí, debemos prestar atención a comparar el nombre del gen y la especie para asegurarnos de que sean consistentes.
 02 Encuentra la secuencia del gen
02 Encuentra la secuencia del gen
(1) Si la secuencia objetivo es ADN genómico, seleccione la primera, que es la secuencia de ADN genómico del gen.
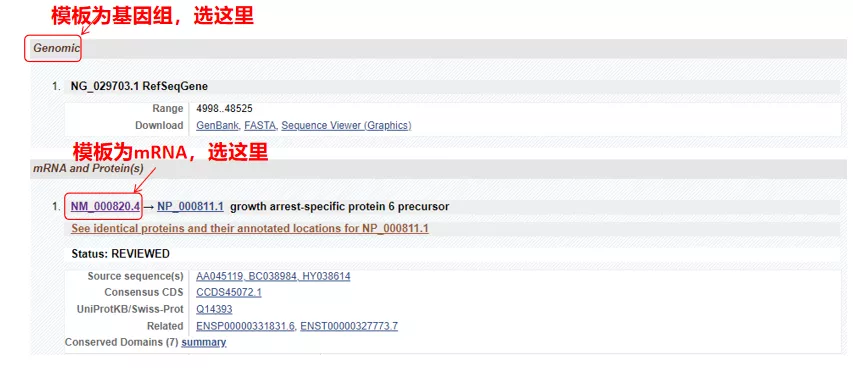 (2) Si la secuencia objetivo es ARNm, seleccione la segunda.Después de ingresar, haga clic en "CDS" en la tabla a continuación.La secuencia de fondo marrón es la secuencia codificante del gen.
(2) Si la secuencia objetivo es ARNm, seleccione la segunda.Después de ingresar, haga clic en "CDS" en la tabla a continuación.La secuencia de fondo marrón es la secuencia codificante del gen.
 03 Imprimaciones de diseño
03 Imprimaciones de diseño
Ingrese a la interfaz Primer-BLAST
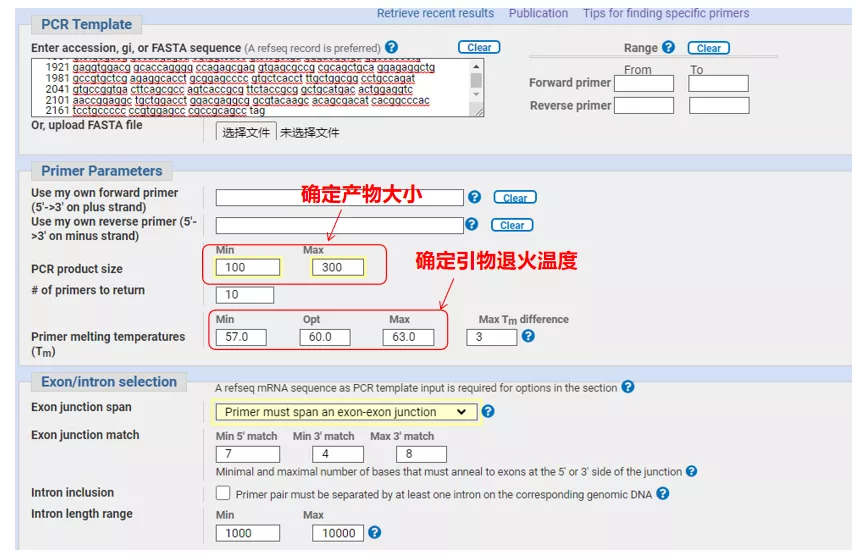
 Ingrese el número de secuencia del gen o la secuencia en formato Fasta en la parte superior izquierda y complete los parámetros relevantes.
Ingrese el número de secuencia del gen o la secuencia en formato Fasta en la parte superior izquierda y complete los parámetros relevantes.
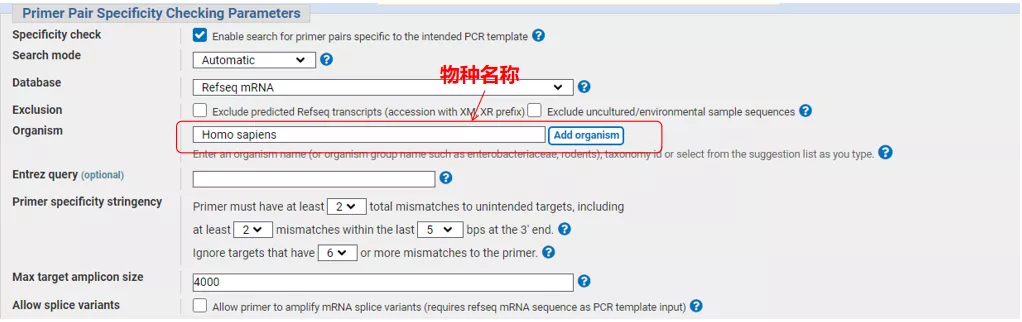
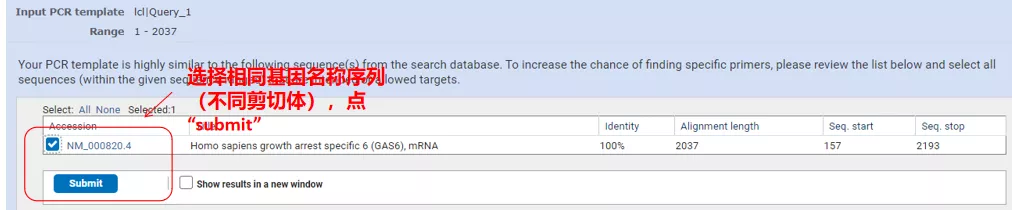
Haga clic en "Obtener cebadores" y aparecerá NCBI para informarle que dicha selección de parámetros se ampliará a otras variantes de empalme.Podemos verificar las diferentes variantes de empalme y enviarlas para obtener el par de cebadores apropiado (como se muestra en la figura a continuación).Este proceso puede tardar decenas de segundos en ejecutarse.
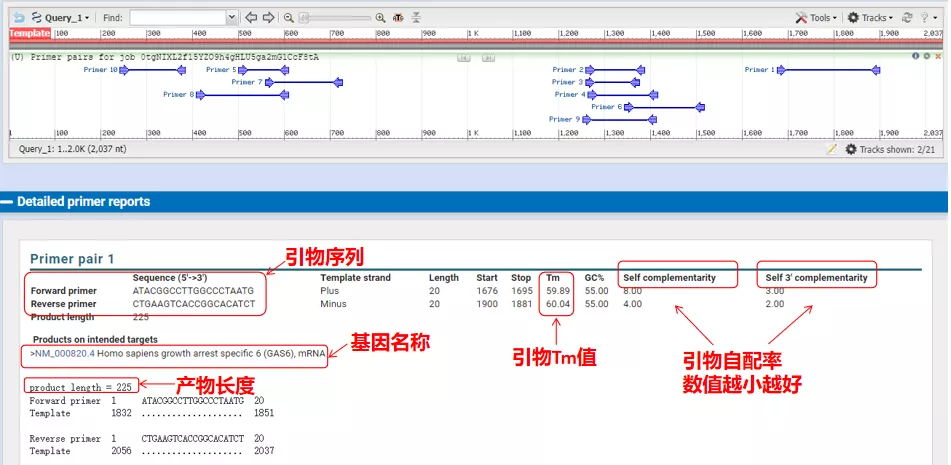 Las temperaturas de recocido de estos pares de cebadores rondan los 60°C.De acuerdo con el propósito del experimento, elija cebadores con longitud moderada, buena especificidad y menos autocomplementación de los cebadores para el experimento, ¡y la tasa de éxito es bastante alta!
Las temperaturas de recocido de estos pares de cebadores rondan los 60°C.De acuerdo con el propósito del experimento, elija cebadores con longitud moderada, buena especificidad y menos autocomplementación de los cebadores para el experimento, ¡y la tasa de éxito es bastante alta!
04Verificación de la especificidad del cebador
De hecho, además de diseñar cebadores, Primer-Blast también puede evaluar los cebadores que diseñamos nosotros mismos.Regrese a la página de diseño de cebadores, ingrese los cebadores aguas arriba y aguas abajo que diseñamos, y no se ajustarán otros parámetros.Después de enviar, puede ver si el par de cebadores también existe en otros genes.Si todos ellos se muestran en el gen que queremos amplificar, ¡lo que indica que la especificidad de este par de cebadores es excelente!(Por ejemplo, ¡este es el único resultado de la consulta inicial!)
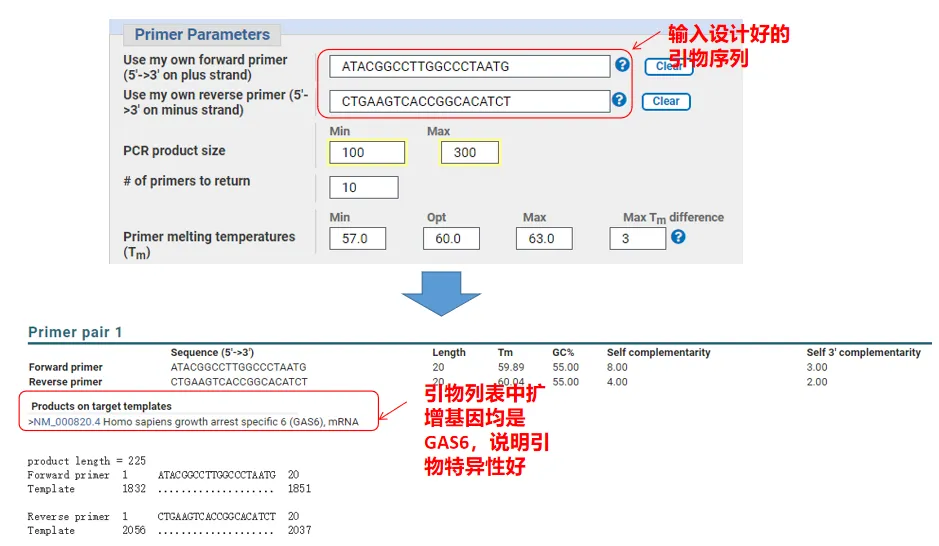
05 Primer juicio de calidad
¿Qué tipo de cebador es el cebador "perfecto" que combina "eficiencia de amplificación hasta el estándar", "características amplificadas del producto" y "resultados experimentales confiables"?
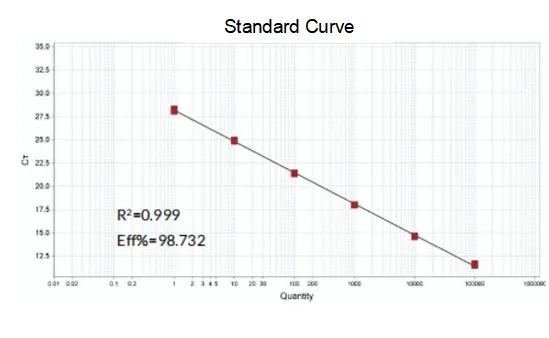 Eficiencia de amplificación
Eficiencia de amplificación
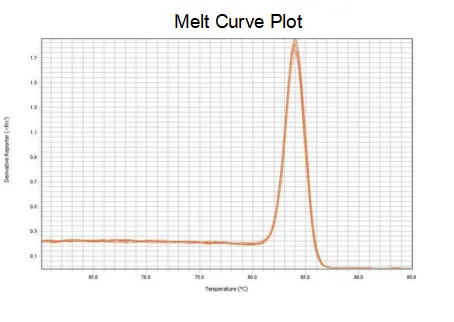 curva de fusión
curva de fusión
La eficiencia de amplificación de los cebadores alcanza el 90 %-110 %, lo que significa que la eficiencia de amplificación es buena, y la curva de fusión tiene un solo pico y, por lo general, Tm>80 °C, lo que significa que la especificidad de amplificación es buena.
Productos relacionados:
Real Time PCR Easy–SYBR GREEN I
PCR en tiempo real Easy-Taqman
Hora de publicación: 10-feb-2023








