Los anticuerpos, también llamados inmunoglobulinas (Ig), son glicoproteínas que se unen específicamente a los antígenos.
La preparación de anticuerpos convencional se produce inmunizando animales y recolectando antisuero.Por lo tanto, el antisuero suele contener anticuerpos contra otros antígenos no relacionados y otros componentes proteicos del suero.Las moléculas de antígeno general contienen en su mayoría múltiples epítopos diferentes, por lo que los anticuerpos convencionales también son una mezcla de anticuerpos contra múltiples epítopos diferentes.Incluso los anticuerpos de suero convencionales dirigidos contra el mismo epítopo todavía están compuestos de anticuerpos heterogéneos producidos por diferentes clones de células B.Por lo tanto, los anticuerpos séricos convencionales también se denominan anticuerpos policlonales o anticuerpos policlonales para abreviar.
El anticuerpo monoclonal (anticuerpo monoclonal) es un anticuerpo altamente uniforme producido por un solo clon de células B y solo dirigido contra un epítopo específico.Por lo general, se prepara mediante tecnología de hibridomas: la tecnología de anticuerpos contra hibridomas se basa en la tecnología de fusión celular, que combina células B con la capacidad de secretar anticuerpos específicos y células de mieloma con capacidad de crecimiento infinita en hibridomas de células B.Esta célula de hibridoma tiene las características de una célula madre.Puede proliferar indefinidamente e inmortalmente in vitro como las células de mieloma, y puede sintetizar y secretar anticuerpos específicos como los linfocitos esplénicos.A través de la clonación, se puede obtener una línea monoclonal derivada de una única célula de hibridoma, es decir, una línea celular de hibridoma.Los anticuerpos que produce son anticuerpos altamente homogéneos contra el mismo determinante antigénico, es decir, anticuerpos monoclonales.
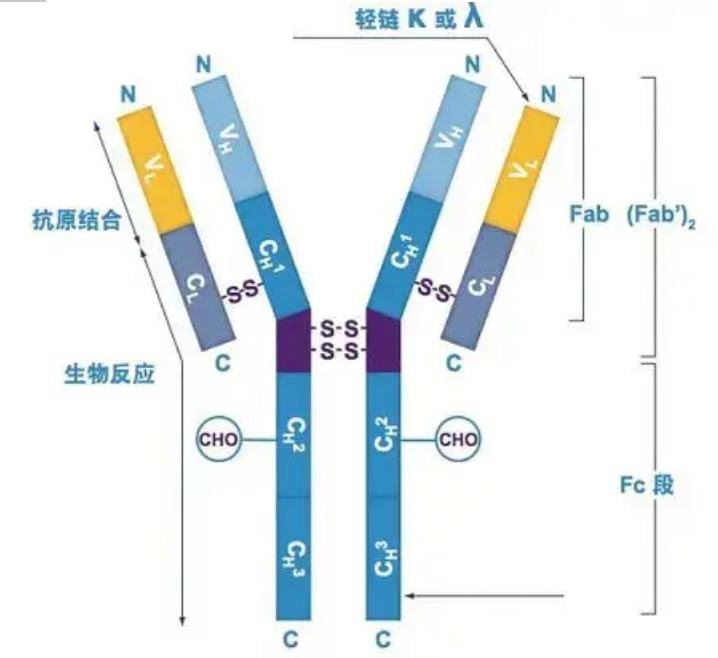
Los anticuerpos existen como uno o más monómeros en forma de Y (es decir, anticuerpos monoclonales o anticuerpos policlonales).Cada monómero en forma de Y se compone de 4 cadenas polipeptídicas, incluidas dos cadenas pesadas idénticas y dos cadenas ligeras idénticas.La cadena ligera y la cadena pesada se nombran según su peso molecular.La parte superior de la estructura en forma de Y es la región variable, que es el sitio de unión al antígeno.(Extracto de Detai Bio-Monoclonal Antibody Concept)
Estructura del anticuerpo
 Cadena pesada
Cadena pesada
Hay cinco tipos de cadenas pesadas de Ig de mamíferos, denominadas con las letras griegas α, δ, ε, γ y μ.Los anticuerpos correspondientes se denominan IgA, IgD, IgE, IgG e IgM.Las diferentes cadenas pesadas difieren en tamaño y composición.α y γ contienen aproximadamente 450 aminoácidos, mientras que μ y ε contienen aproximadamente 550 aminoácidos.
Cada cadena pesada tiene dos regiones: la región constante y la región variable.Todos los anticuerpos del mismo tipo tienen la misma región constante, pero existen diferencias entre anticuerpos de diferentes tipos.Las regiones constantes de las cadenas pesadas γ, α y δ están compuestas por tres dominios Ig en tándem, con una región bisagra para aumentar su flexibilidad;las regiones constantes de las cadenas pesadas μ y ε están compuestas por 4 dominios Ig.La región variable de la cadena pesada del anticuerpo producido por diferentes células B es diferente, pero la región variable del anticuerpo producido por la misma célula B o clon celular es la misma, y la región variable de cada cadena pesada tiene una longitud de aproximadamente 110 aminoácidos., y forman un solo dominio Ig.
Cadena de luz
Solo hay dos tipos de cadenas ligeras en los mamíferos: tipo lambda y tipo kappa.Cada cadena ligera tiene dos dominios enlazados: una región constante y una región variable.La longitud de la cadena ligera es de unos 211~217 aminoácidos.Las dos cadenas ligeras contenidas en cada anticuerpo son siempre las mismas.Para los mamíferos, la cadena ligera de cada anticuerpo tiene un solo tipo: kappa o lambda.En algunos vertebrados inferiores, como los peces cartilaginosos (peces de cartílago) y los peces óseos, también se encuentran otros tipos de cadenas ligeras como las del tipo iota (iota).
Segmentos Fab y Fc
El segmento Fc se puede combinar directamente con enzimas o tintes fluorescentes para marcar anticuerpos.Es la parte donde el anticuerpo se remacha en la placa durante el proceso ELISA, y también es la parte donde el segundo anticuerpo se reconoce y se une en inmunoprecipitación, inmunotransferencia e inmunohistoquímica.Los anticuerpos pueden hidrolizarse en dos segmentos F(ab) y un segmento Fc mediante enzimas proteolíticas como la papaína, o pueden separarse de la región bisagra mediante pepsina e hidrolizarse en un segmento F(ab)2 y un segmento Fc.Los fragmentos de anticuerpos IgG a veces son muy útiles.Debido a la falta del segmento Fc, el segmento F(ab) no precipitará con el antígeno, ni será capturado por las células inmunitarias en estudios in vivo.Debido a los pequeños fragmentos moleculares y la falta de función de entrecruzamiento (debido a la falta del segmento Fc), el segmento Fab generalmente se usa para el marcaje radiactivo en estudios funcionales, y el segmento Fc se usa principalmente como agente de bloqueo en la tinción histoquímica.
Regiones variables y constantes
La región variable (región V) está ubicada en 1/5 o 1/4 (que contiene aproximadamente 118 residuos de aminoácidos) de la cadena H cerca del extremo N-terminal y 1/2 (que contiene aproximadamente 108-111 residuos de aminoácidos) cerca del extremo N-terminal de la cadena L.Cada región V tiene un anillo peptídico formado por enlaces disulfuro dentro de la cadena, y cada anillo peptídico contiene aproximadamente de 67 a 75 residuos de aminoácidos.La composición y la disposición de los aminoácidos en la región V determinan la especificidad de unión al antígeno del anticuerpo.Debido a los tipos y secuencias de aminoácidos en constante cambio en la región V, se pueden formar muchos tipos de anticuerpos con diferentes especificidades de antígeno de unión.Las regiones V de la cadena L y la cadena H se denominan VL y VH, respectivamente.En VL y VH, la composición y secuencia de aminoácidos de algunas regiones locales tienen un mayor grado de variación.Estas regiones se denominan regiones hipervariables (HVR).La composición de aminoácidos y la disposición de las partes que no son HVR en la región V son relativamente conservadoras, lo que se denomina región marco.Hay tres regiones hipervariables en VL, generalmente ubicadas en los residuos de aminoácidos 24 a 34 y 89 a 97 respectivamente.Los tres HVR de VL y VH se denominan HVR1, HVR2 y HVR3, respectivamente.La investigación y el análisis de la difracción de cristales de rayos X demostraron que la región hipervariable es de hecho el lugar donde se une el antígeno del anticuerpo, por lo que se denomina región determinante de la complementariedad (CDR).Los HVR1, HVR2 y HVR3 de VL y VH pueden denominarse CDR1, CDR2 y CDR3 respectivamente.Generalmente, CDR3 tiene un mayor grado de hipervariabilidad.La región hipervariable es también el lugar principal donde existen los determinantes idiotípicos de las moléculas de Ig.En la mayoría de los casos, la cadena H juega un papel más importante en la unión al antígeno.
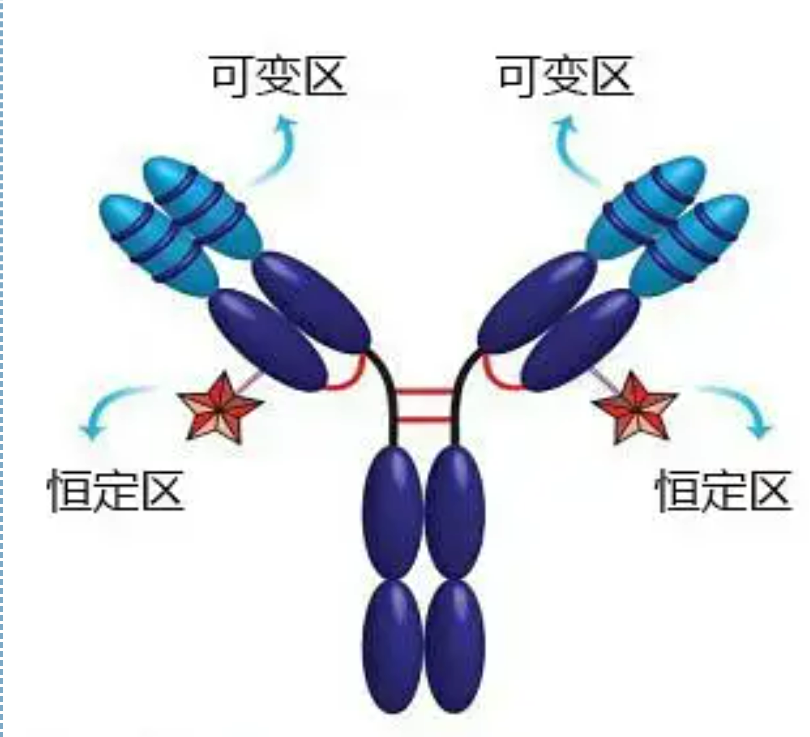 La región constante (región C)está ubicado en 3/4 o 4/5 (aproximadamente desde el aminoácido 119 hasta el extremo C terminal) de la cadena H cerca del extremo C terminal y 1/2 (contiene alrededor de 105 residuos de aminoácidos) cerca del extremo C terminal de la cadena L.Cada región funcional de la cadena H contiene alrededor de 110 residuos de aminoácidos y contiene un anillo peptídico compuesto por 50-60 residuos de aminoácidos conectados por enlaces disulfuro.La composición de aminoácidos y la disposición de esta región son relativamente constantes en la misma cadena L de isotipo Ig animal y en la misma cadena de tipo H.Lo mismo, solo puede unirse específicamente al antígeno correspondiente, pero la estructura de su región C es la misma, es decir, tiene la misma antigenicidad.El anticuerpo secundario IgG anti-humano de caballo (o anti-anticuerpo) se puede combinar con los dos. Se produce una combinación de anticuerpos (IgG) contra diferentes exotoxinas.Esta es una base importante para preparar anticuerpos secundarios y aplicar fluoresceína, isótopos, enzimas y otros anticuerpos marcados.
La región constante (región C)está ubicado en 3/4 o 4/5 (aproximadamente desde el aminoácido 119 hasta el extremo C terminal) de la cadena H cerca del extremo C terminal y 1/2 (contiene alrededor de 105 residuos de aminoácidos) cerca del extremo C terminal de la cadena L.Cada región funcional de la cadena H contiene alrededor de 110 residuos de aminoácidos y contiene un anillo peptídico compuesto por 50-60 residuos de aminoácidos conectados por enlaces disulfuro.La composición de aminoácidos y la disposición de esta región son relativamente constantes en la misma cadena L de isotipo Ig animal y en la misma cadena de tipo H.Lo mismo, solo puede unirse específicamente al antígeno correspondiente, pero la estructura de su región C es la misma, es decir, tiene la misma antigenicidad.El anticuerpo secundario IgG anti-humano de caballo (o anti-anticuerpo) se puede combinar con los dos. Se produce una combinación de anticuerpos (IgG) contra diferentes exotoxinas.Esta es una base importante para preparar anticuerpos secundarios y aplicar fluoresceína, isótopos, enzimas y otros anticuerpos marcados.
Productos relacionados:
Kit Cell Direct RT-qPCR
Hora de publicación: 30-sep-2021








