Descripción general
Identificación rápida de plantas transgénicas
Texto/Tong Yucheng
Operación experimental/Han Ying
Editor/Wen Youjun
Palabras/1600+
Tiempo de lectura sugerido/8-10 minutos
Identificación rápida de plantas transgénicas
Como principiante en el laboratorio, no es un buen trabajo descartar plantas positivas de un grupo de plantas con una tasa de conversión baja.En primer lugar, el ADN debe extraerse de una gran cantidad de muestras una por una, y luego los genes extraños se detectarán mediante PCR.Sin embargo, los resultados a menudo son espacios en blanco y bandas con algunos elementos ocasionalmente, pero es imposible determinar si hay detecciones perdidas o detecciones falsas..¿Es muy impotente enfrentar tal proceso experimental y resultados?No te preocupes, hermano te enseña cómo descartar plantas transgénicas positivas de manera fácil y precisa.
Paso 1: Cebadores de detección de diseño
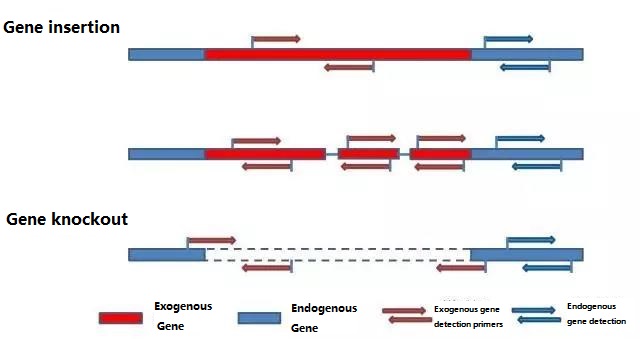
Determine el gen endógeno y el gen exógeno que se detectará de acuerdo con la muestra que se analizará y seleccione una secuencia representativa de 100-500 pb en el gen para el diseño de cebadores.Los buenos cebadores pueden garantizar la precisión de los resultados de detección y acortar el tiempo de detección (consulte el apéndice para conocer los cebadores de detección de uso común).
Nota:
Los cebadores de nuevo diseño deben optimizar las condiciones de reacción y verificar la exactitud, la precisión y el límite de detección de la detección antes de realizar una detección a gran escala.
Paso 2:Desarrollar un protocolo experimental

Control positivo: use el ADN purificado que contiene el fragmento objetivo como plantilla para determinar si el sistema de reacción de PCR y las condiciones son normales.
Control negativo/en blanco: use una plantilla de ADN o ddH2O que no contiene el fragmento objetivo como plantilla para detectar si existe una fuente de contaminación en el sistema de PCR.
Control de referencia interno: utilice la combinación cebador/sonda del gen endógeno de la muestra que se va a analizar para evaluar si la plantilla se puede detectar mediante PCR.
Nota:
Se deben establecer controles positivos, negativos/en blanco y controles internos para cada prueba para evaluar la validez de los resultados experimentales.
Paso 3: Preparación del experimento

Antes de usar, observe si la solución se mezcla uniformemente.Si se encuentra precipitación, debe disolverse y mezclarse de acuerdo con las instrucciones antes de su uso.La mezcla 2×PCR debe pipetearse y mezclarse repetidamente con una micropipeta antes de su uso para evitar una distribución irregular de iones.
Nota:
Saque las instrucciones y léalas cuidadosamente, y haga los preparativos antes del experimento en estricta conformidad con las instrucciones.
Paso 4: preparar el sistema de reacción de PCR
De acuerdo con el protocolo experimental, mezcle los cebadores, H2O, 2xPCR mezclar, centrifugar y distribuirlos en cada tubo de reacción.
Nota:
Para pruebas a gran escala o a largo plazo, se recomienda utilizar un sistema de reacción de PCR que contenga enzima UNG, que puede evitar de manera efectiva la contaminación por aerosol causada por los productos de PCR.
Paso 5: Agregar plantilla de reacción

Con la tecnología Direct PCR, no hay necesidad de un tedioso proceso de purificación de ácidos nucleicos.La plantilla de muestra puede prepararse en 10 minutos y agregarse al sistema de reacción de PCR correspondiente.
Nota:
El método Lysis tiene un mejor efecto de detección y el producto obtenido se puede utilizar para múltiples reacciones de detección.
5.1: PCR directa de hojas
De acuerdo con el tamaño de la imagen en el manual, corte el tejido de la hoja con un diámetro de 2-3 mm y colóquelo en el sistema de reacción de PCR.
Nota: asegúrese de que los fragmentos de hoja estén completamente sumergidos en la solución de reacción de PCR y no agregue demasiado tejido de hoja.
5.2: Método de lisis de hojas
Corte el tejido de la hoja con un diámetro de 5-7 mm y colóquelo en un tubo de centrífuga.Si elige hojas maduras, evite usar los tejidos de la nervadura principal de la hoja.Pipetee 50 ul de lisado de tampón P1 en un tubo de centrífuga para asegurarse de que el lisado pueda sumergir completamente el tejido de la hoja, colóquelo en un termociclador o en un baño de metal y lisis a 95 °C durante 5-10 minutos.


Agregue 50 ul de solución de neutralización de tampón P2 y mezcle bien.El lisado resultante puede usarse como plantilla y agregarse al sistema de reacción de PCR.
Nota: La cantidad de plantilla debe estar entre el 5 y el 10 % del sistema de PCR y no debe exceder el 20 % (por ejemplo, en un sistema de PCR de 20 μl, agregue 1 a 2 μl de tampón de lisis, no más de 4 μl).
Paso 6: Reacción de PCR

Después de centrifugar el tubo de reacción de PCR, colóquelo en un instrumento de PCR para amplificación.
Nota:
La reacción utiliza una plantilla no purificada para la amplificación, por lo que el número de ciclos de amplificación es de 5 a 10 ciclos más que cuando se utiliza una plantilla de ADN purificada.
Paso 7: Detección de electroforesis y análisis de resultados

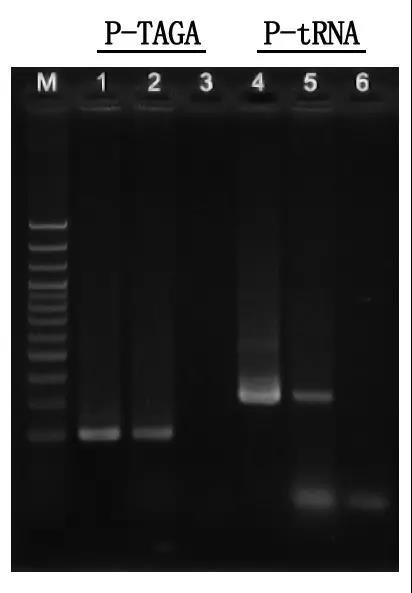
M: escalera de ADN de 100 pb
1\4: método de ADN purificado
2\5: método PCR directo
3\6: control en blanco
Control de calidad:
Los resultados de las pruebas de los diversos controles establecidos en el experimento deben cumplir las siguientes condiciones.De lo contrario, se debe analizar la causa del problema y se debe realizar la prueba nuevamente después de eliminar el problema.
Tabla 1. Resultados normales de las pruebas de varios grupos de control

*Cuando el plásmido se utiliza como control positivo, el resultado de la prueba del gen endógeno puede ser negativo
Juicio de resultado:
A. El resultado de la prueba del gen endógeno de la muestra es negativo, lo que indica que el ADN adecuado para la detección por PCR ordinaria no se puede extraer de la muestra o que el ADN extraído contiene inhibidores de la reacción de PCR, y el ADN debe extraerse nuevamente.
B. El resultado de la prueba del gen endógeno de la muestra es positivo y el resultado de la prueba del gen exógeno es negativo, lo que indica que el ADN adecuado para la detección por PCR ordinaria se extrae de la muestra y se puede juzgar que el gen XXX no se detecta en la muestra.
C. El resultado de la prueba del gen endógeno de la muestra es positivo y el resultado de la prueba del gen exógeno es positivo, lo que indica que el ADN adecuado para la detección por PCR ordinaria se ha extraído de la muestra y el ADN de la muestra contiene el gen XXX.Los experimentos de confirmación se pueden llevar a cabo más.
Paso 8: Diseñe cebadores de detección

Después del experimento, use una solución de hipoclorito de sodio al 2% y una solución de etanol al 70% para limpiar el área experimental y evitar la contaminación ambiental.
Apéndice
Tabla 2. Cebadores de uso común para la detección general por PCR de plantas modificadas genéticamente
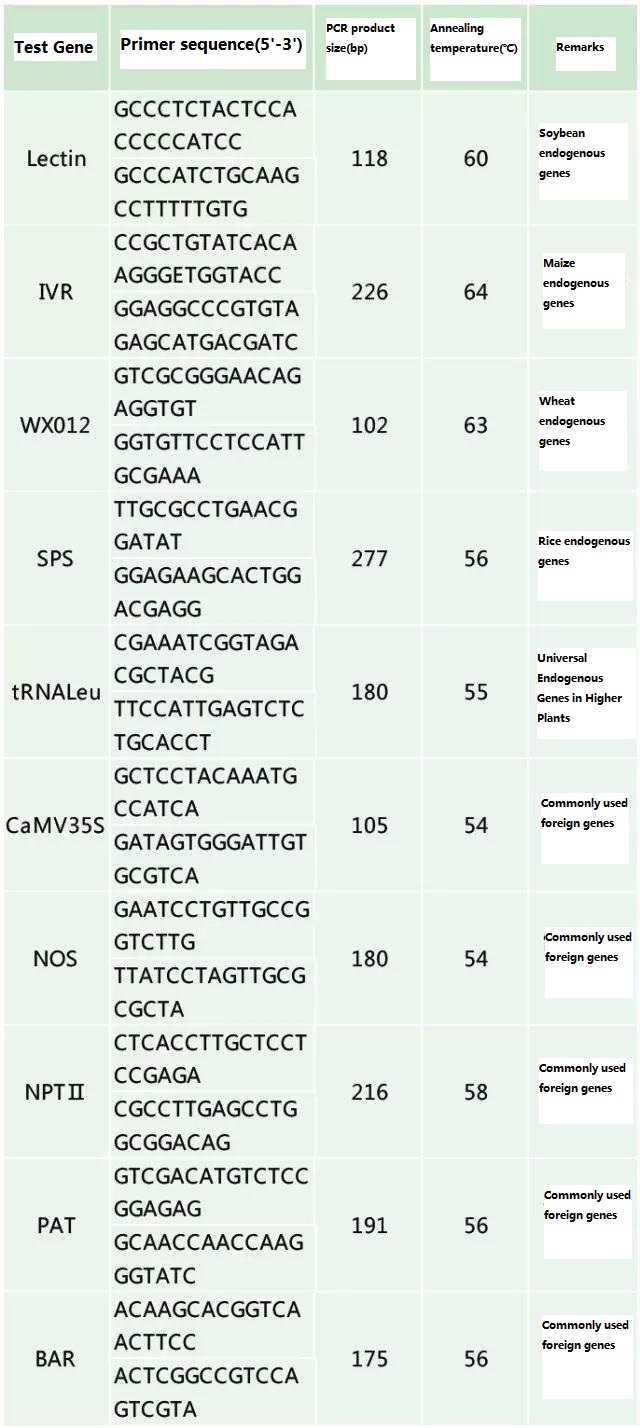
Documento de referencia:
SN/T 1202-2010, Método cualitativo de detección por PCR para ingredientes vegetales genéticamente modificados en alimentos.
Anuncio del Ministerio de Agricultura 1485-5-2010, Pruebas de los ingredientes de plantas genéticamente modificadas y sus productos-arroz M12 y sus derivados.
Hora de publicación: 09-jun-2021








